
Korrosion
Unter Korrosion versteht man den Angriff und die Zerstörung metallischer Werkstoffe durch chemische oder elektrochemische Reaktionen mit Wirkstoffen der Umgebung.
Man unterscheidet zwei Korrosionsarten: Bei der chemischen Korrosion reagiert der Werkstoff direkt mit dem angreifenden Wirkstoff, bei der elektrochemischen Korrosion ist dazu noch ein Elektrolyt nötig.
Chemische Korrosion
Chemische Korrosion tritt beim Härten, Glühen, Schmieden, Schweissen und beim Hochtemperaturlöten von Werkstücken auf.
| 4 Fe | + 3 O2 | = 2 Fe2O3 |
| Eisen | Sauerstoff | Eisenoxid |
In trockener Umgebung reagieren die Metalle erst bei hohen Temperaturen mit Sauerstoff. Chemische Korrosion wird daher auch Hochtemperaturkorrosion oder Verzunderung genannt.
Schutzmassnahmen
Um die Werkstücke vor Verzunderung zu schützen, wird der Sauerstoff im Härteofen mit Hilfe von brennbarem Gas (Formiergas N2H2), verbrannt. Die Schweissstelle wird mit Schutzgas umhüllt, die den Sauerstoff verdrängt. Einige Schutzgase sind Kohlendioxid (CO2), Argon (Ar) und Helium (He).
Elektrochemische Korrosion
So wird Korrosion bezeichnet, die durch den Potentialunterschied in unterschiedlichen Metallen zustande kommt. Da jedes Metall ein anderes Potential (Fähigkeit, Elektronen abzugeben) hat, kommt es zu einer Spannungsdifferenz. Es bilden sich zwei Pole, ein Pol mit niedrigerem Potential (Anode) und ein Pol mit höherem Potential (Kathode). Betrachtet man die beiden Pole und die Reaktionen, die zwischen den Polen stattfinden als ein geschlossenes System, so spricht man von einem Korrosionselement oder einer Korrosionszelle.
Korrosionsverhalten
Elektrochemische Spannungsreihe
Korrosionselemente
Rosten von Eisen
Korrosionsarten
Schutzmassnahmen
Korrosionsverhalten
Berühren sich zwei Metalle und tritt ein Elektrolyt dazu, so löst sich das unedlere auf und das edlere bleibt bestehen. Solche Systeme nennt man „Galvanische Elemente".
Ein galvanisches Element besteht aus zwei Elektroden aus unterschiedlichen Metallen, die in einen Elektrolyt getaucht werden (Bild). Dabei löst sich das unedlere der beiden Metalle auf, es korrodiert.
Die unedleren Metallatome haben das grössere Bestreben, in die stabileren Metallionen überzugehen bzw. 8 Valenzelektronen zu haben. Durch diesen Vorgang lassen sie jedoch Elektronen auf dem Metall zurück, die nun wegen der guten elektrischen Leitfähigkeit zum edleren Metall fliessen. Das Abfliessen der Elektronen bewirkt nun, dass noch mehr Atome des unedleren Metalls in die Ionenform übergehen und sich dieses daher weiter auflöst. Das edlere Metall wird durch den Elektronenzufluss negativ aufgeladen und daher können keine Metallionen gebildet werden.
Elektronen können aber auch durch Erdung oder durch Teilchen im Elektrolyten (bei Wasser: H+-Ionen) stetig abgeführt werden und die Korrosion massiv beschleunigen.
Elektrochemische Spannungsreihe
Die negative Aufladung eines Metalls in einem Elektrolyt ist ein Mass für seine Edlität.
Die Messung der Aufladung eines Metalls ist messtechnisch nicht direkt möglich, da man einen Nullvergleich haben müsste. Man hat sich daher entschlossen, die so genannte Normalwasserstoffelektrode als Nullpunkt zu setzen und die Aufladung aller anderen Metalle unter genormten Bedingungen dagegen zu vergleichen.
Das Aufreihen der so erhaltenen Spannungen (Potentiale) der Metalle ergibt die Elektrochemische Spannungsreihe (Tabelle).
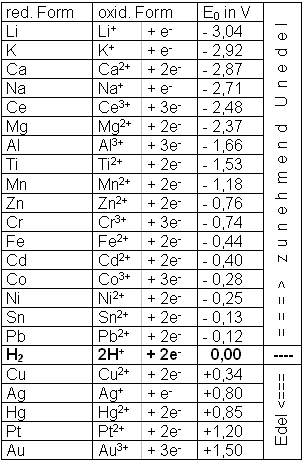
Sie liefert uns folgende Informationen:
- Edlität (je negativer, desto unedler)
- Spannung zwischen zwei Metallen
- Korrosionsverhalten (das Unedlere korrodiert)
Korrosionselemente
Um ein Korrosionselement zu bilden, sind zwei unterschiedliche Metalle (Elektroden) und etwas Flüssigkeit (Elektrolyt) erforderlich.
Einige Beispiele:
- Schadstellen an Metallüberzügen auf Stahlbauteilen
- unterschiedliche Gefügebestandteile (Körner) in Legierungen
- Berührungsstellen zweier Bauteile aus unterschiedlichen Werkstoffen (Hervorgerufen z.B. durch Verschrauben, Vernieten, Plattieren, Löten oder Schweissen)
Das jeweils unedlere Metall wird an diesen Stellen durch elektrolytisches Auflösen zerstört.
Achtung: Einige Metalle verhalten sich in der Praxis nicht so, wie es aus der Spannungsreihe der Metalle zu erwarten ist! Sie bilden bei der anfänglichen Sauerstoff-Korrosion eine schützende Oxidschicht. Beispiele dafür sind Aluminium, Chrom, Zink, Titan und korrosionsbeständige Edelstahllegierungen. Diesen Vorgang bezeichnet man als Passivierung.
Rosten von Eisen
Damit Eisen überhaupt rosten kann braucht es einen Elektrolyt (Wasser, Handschweiss) und Sauerstoff.
Die Zahlen im Text beziehen sich auf das Bild unten, das den Vorgang des Rostens veranschaulicht.
Auf einer Eisenoberfläche (grau) liegt ein Wassertropfen (blau), umgeben von Luft (weiss). In der Mitte des Tropfens (1) geht Eisen als Fe2+-Ionen in Lösung.

Die Oberfläche des Wassertropfens ist mit Sauerstoff angereichert. Der Konzentrationsunterschied im Wassertropfen erzeugt eine Potenzialdifferenz zwischen (2) und (3). Der anodische Bereich (2) und kathodische Bereich (3) bilden mit dem Wasser als Elektrolyten ein galvanisches Element, das aufgrund des Kurzschlusses zwischen (2) und (3) als Korrosionselement bezeichnet wird.
Bei (3) reagieren die Elektronen mit Wasser und Sauerstoff zu Hydroxid (OH-). Die Hydroxid-Ionen bilden bei (4) mit den Eisenionen Eisenhydroxid Fe(OH)2. Unter Beteiligung von Sauerstoff und Wasser entsteht schwerlösliches Eisenhydroxid Fe(OH)3, das sich auf der Eisenoberfläche bei (5) ablagert. Durch Wasserabspaltung bildet sich schliesslich Rost Fe2O3 oder FeO(OH).
Reaktionsgleichung:
2 Fe + O2 + 2 H2O => Fe(OH)2
4 Fe(OH)2 + O2 + 2H2O => 4 Fe(OH)3
2 Fe(OH)3 => Fe2O3 + 3H2O (roter Rost - Eisenoxid)
Fe(OH)3 => FeO(OH) + H2O (Eisenhydroxid)
Korrosionsarten
Je nach Werkstoff, Korrosionselement und Beanspruchung des Bauteils unterscheidet man verschiedene Korrosionsarten:
Gleichmässige Flächenkorrosion
Die Oberfläche des Bauteils wird gleichmässig abgetragen.
Mulden- oder Narbenkorrosion
Durch die Korrosion treten örtlich begrenzte mulden- oder narbenartige Schäden auf.
Lochfrasskorrosion
Das Grundmetall wird stellenweise lochartig an- und durchgefressen, die übrige Oberfläche gerät dabei wenig oder gar nicht in Mitleidenschaft.
Spaltkorrosion
Verstärkte Korrosion in Spalten oder Rissen bzw. an den Berührungsflächen zweier metallischer Körper.
Kontaktkorrosion
Entsteht, wenn ein edleres Metall mit einem unedleren in Berührung kommt, und ein Elektrolyt vorhanden ist. Das unedlere Metall löst sich dabei auf.
Belüftungskorrosion
Tritt knapp unterhalb des Wasserstandes von Behältern auf. Ursache ist der unterschiedliche Sauerstoffgehalt an der Oberfläche und in tieferen Schichten des Wassers.
Selektive Korrosion
Sie wird unterteilt in:
- Interkristalline Korrosion: Von aussen gar nicht oder kaum wahrnehmbar, da die Korrosion an den Korngrenzen verläuft.
- Transkristalline Korrosion: Die Korngrenzensubstanz bleibt erhalten, denn die Korrosion bevorzugt das Korninnere.
Spannungsrisskorrosion
Unter Spannungsrisskorrosion versteht man eine (elektro-)chemische Korrosion eines Metalls unter gleichzeitiger Einwirkung eines Korrosionsmittels und einer statischen Zugspannung.
Schwingungsrisskorrosion
Beim Zusammenwirken von mechanischer Wechselbeanspruchung und Korrosion tritt Schwingungsrisskorrosion auf.
Schutzmassnahmen
Damit ein Werkstoff Korrosion erleidet, braucht es einen Elektrolyt, eine Potenzialdifferenz und bei Eisen noch Sauerstoff. Daraus lassen sich drei Strategien ableiten:
1. Fernhalten von Sauerstoff
2. Fernhalten von Feuchtigkeit, die als Elektrolyt wirkt
3. Abbau der Potenzialdifferenz in Lokalelementen
Auch mit der Auswahl von geeigneten Werkstoffen, einer korrosionsschutzgerechten Konstruktion sowie dem Einsatz von korrosionshemmenden Stoffen (Inhibitoren) kann die Korrosion verhindert werden.
Fernhalten von Sauerstoff
Heizungsrohre aus Eisen rosten kaum, wenn das Wasser in einem geschlossenen System ohne Luftzutritt geführt wird.
Fernhalten von Feuchtigkeit, die als Elektrolyt wirkt
Blanke Stahlteile:
- Einölen
- Einfetten
Nichtmetallische Überzüge:
- Korrosionsschutzanstriche
- Lackierungen
- Emaillieren
Metallische Überzüge:
- Edlere Überzüge schützen nur bei intakter Deckschicht
- Unedlere Metallüberzüge schützen den Werkstoff auch bei defekter Deckschicht
Chemische / Elektrochemische Schutzschichten:
- Brünieren
- Eloxieren
- Phosphatieren
- Chromatieren
Abbau der Potenzialdifferenz in Lokalelementen
Unedlere Metallüberzüge (z.B. Feuerverzinkung):
- Kommt es zu einer Schädigung der Beschichtung, bilden Zink und Eisen bei Zutritt von Wasser ein Lokalelement. Zink als das unedlere Metall korrodiert und bewahrt das Eisen vor einer Zersetzung.
Opferanoden (meist Magnesium):
- Korrosionsgefährdete Werkstoffe werden mit unedlen Metallen verbunden. Um das Bauteil zu schützen, lösen sich die Magnesiumplatten auf. Die Bodenfeuchtigkeit dient dabei als Elektrolyt.
Fremdstromanoden:
- Statt einer Opferanode schützt auch eine elektrisch leitende Elektrode (z.B. Graphit) gegen Korrosion. Das Bauteil ist dabei an den negativen Pol einer Batterie angeschlossen, während Graphitanoden am positiven Pol hängen. Das Bauteil wird dadurch zur Kathode und ist somit gegen Korrosion geschützt.
Anwendung von kathodischem Korrosionsschutz: Pipelines, Wasserversorgungsanlagen, Tanklager